Da auch SARS-CoV-2 Fieber, Schmerzen und Schnupfen auslösen kann, geben Sie Ihren Patient:innen mit Erkältungssymptomen in dieser Saison die aktuellsten Forschungsergebnisse mit!
Wenig Zeit? Erfahren Sie hier kurz & knapp, welche Relevanz die aktuelle Forschung für Sie hat!
Schon gewusst? Antivirale Effekte von Aspirin®-Wirkstoff ASS gegen respiratorische Viren wie Rhino- oder Influenzaviren
Bei Erkältungskrankheiten lindert das Aspirin®-Portfolio dank seiner antipyretischen und analgetischen Eigenschaften schnell viele Beschwerden – von den ersten Anzeichen bis zur ausgeprägten Erkältung mit Schnupfen2,3. Zusätzlich zur reinen Symptomlinderung bei Erkältungskrankheiten bietet Aspirin® auch antivirale Effekte, die in vitro und in Tierversuchen nachgewiesen werden konnten. Die antivirale Wirkung von ASS bei gängigen Rhino-4 und Influenzaviren5,6 zeigt sich dabei in der Hemmung der Virusvermehrung und beruht auf der Downregulierung eines Adhäsionsmoleküls. Da SARS-CoV-2 möglicherweise die gleichen Wege zur Vermehrung wie Influenzaviren nutzt, liegt die Vermutung nahe, dass das ASS in Aspirin® auch bei Coronaviren ähnliche Effekte zeigen könnte.
Beeindruckende Ergebnisse: Inhibition der SARS-CoV-2-Replikation durch ASS und Salicylsäure
Ergebnisse auf einen Blick
In der aktuellen ex vivo Studie wurden verschiedene Zellkulturen sowie ein patientennahes Replikationssystem (humane Lungenpräzisionsschnitte, PCLS) daraufhin untersucht, ob das ASS in Aspirin® antivirale Effekte bei SARS-CoV-2 zeigt. Alle Zellen wurden mit Acetylsalicylsäure (ASS) sowie dessen aktivem Metaboliten Salicylsäure (SS) behandelt und anschließend mit SARS-CoV-2 infiziert.1
Forschungsrelevanz – das kann die aktuelle ex-vivo-Studie leisten
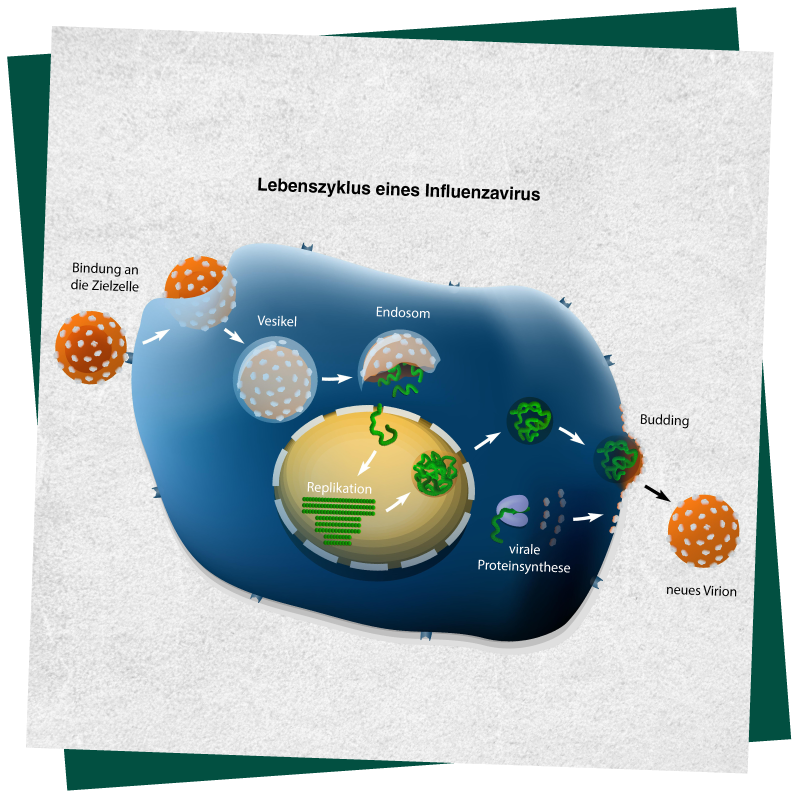
SARS-CoV-2 ist ein umhülltes Plusstrang-RNA-Virus mit Spike-Proteinen auf seiner Oberfläche. Das Virus nutzt diese, um über das Angiotensin-konvertierende Enzym 2 (ACE2) in die Zellen einzudringen.7 Das Virus gelangt über zelltypspezifische, pH-abhängige Endozytose oder durch direkte Fusion mit der Zytoplasmamembran in die Zelle, abhängig von der Konzentration zellulärer TMPRSS2-Proteasen.8 Die eingehende virale RNA wird in virale Proteine übersetzt und von der viralen RNA-Polymerase exprimiert.9 Daher führt eine Hemmung der viralen Replikationsschritte vom Eintritt in die Zelle bis zur RNA-Expression zu einem geringeren Anstieg der RNA-Mengen in den Zellen.
Die Analyse der viralen Replikationszyklen liefert wichtige Erkenntnisse für die Entwicklung und Verbesserung neuer Virostatika und für das Verständnis, wo diese Medikamente die virale Replikation beeinträchtigen könnten.1
Abbildung 1.
Schematische Darstellung der Virusreplikation von SARS-CoV-2 in menschlichen Zellen.1
In der oben vorgestellten Studie von Geiger et al.1 wurde untersucht, wo genau Acetylsalicylsäure und Salicylsäure die Replikation von SARS-CoV-2 in Zellkulturen und in menschlichen Lungenpräzisionsschnitten hemmen könnten. Es konnte gezeigt werden, dass die Substanzen nicht den Eintritt des Virus, sondern die Replikationsschritte vor oder während der Genexpression beeinträchtigen.1 Die Ergebnisse aus der aktuellen ex vivo Studie sind vielversprechend und weitere Studien werden den genauen Wirkmechanismus in der nahen Zukunft weiter entschlüsseln.
Details zur ex vivo Untersuchung
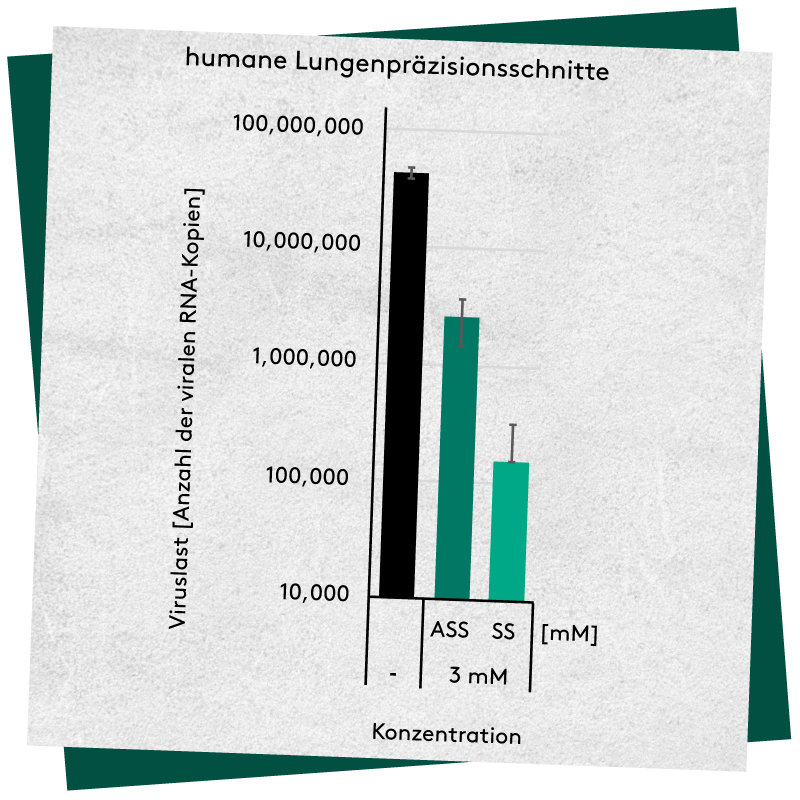
ASS und SS hemmten die virale Replikation auf zelltypspezifische Weise signifikant um bis zu zwei Größenordnungen. Diese Reduktion ist stärker als die zuvor bereits berichtete Wirkung auf Influenza- und Rhinoviren4-6 was darauf hindeutet, dass ASS und SS einen wichtigen, replikationsrelevanten SARS-CoV-2-Pathway hemmen könnten. Die Hemmung der SARS-CoV-2-Replikation ist dabei unabhängig von den verwendeten Zelllinien und beide Verbindungen unterdrücken die virale Replikation sogar in den hochrelevanten A549-Zellen.1 Auch in einem patientennäheren Replikationssystem (menschliche Lungenpräzisionsschnitte, PCLS) konnten diese Ergebnisse bestätigt werden (Abbildung 2).
Abbildung 2.
Salicylsäure (SS) und ASS hemmen die Virusreplikation in humanen Lungenpräzisionsschnitten (PCLS). PCLS wurden mit den Substanzen behandelt und anschließend mit SARS-CoV-2 infiziert. Die Viruslast wurde 3 Tage nach der Infektion bestimmt. Die Balken stellen den Mittelwert und die Fehlerbalken die Standardabweichung dar.1
Wie genau hemmen ASS und Salicylsäure die Replikation von SARS-CoV-2?
Um die Frage zu beantworten, wurden A549-ACE2-Zellen mit ASS und SS inkubiert. 6 Stunden nach der anschließenden Infektion mit SARS-Cov-2 wurde gezeigt, dass trotz der Behandlung gleiche Mengen des Virus in die Zellen gelangen konnten wie in unbehandelten Zellen. Daraus kann abgeleitet werden, dass der virale Eintrittsprozess bei SARS-CoV-2-Infektionen nicht zielgerichtet gehemmt wird.
24 Stunden nach Infektion wurde eine Verringerung der viralen RNA-Mengen unter Behandlung mit beiden Substanzen gegenüber unbehandelten Zellen beobachtet. Dies deutet darauf hin, dass die Substanzen Replikationsschritte nach dem viralen Eintritt in die Zellen, aber vor oder während der Genexpression hemmen.1
Abbildung 3.
Salicylsäure (SS) und ASS blockieren nicht den Eintritt von SARS-CoV-2 in A549-Zellen, sondern die Replikationsschritte vor oder während der Genexpression. Zellkulturen wurden mit verschiedenen Konzentrationen von ASS und SS behandelt und anschließend mit SARS-CoV-2 infiziert. Die Gesamt-RNA der Zellen wurde nach 6 (A) und 24 Stunden (B) isoliert, und die SARS-CoV-2-RNA mittels RTqPCR quantifiziert. Die Balken stellen den Mittelwert und die Fehlerbalken die Standardabweichung dar.

Zusammengefasst: ASS und Salicylsäure zeigen in verschiedenen aus Tieren und Menschen gewonnenen Zelllinien und in humanen Lungenpräzisionsschnitten (PCLS) antivirale Effekte gegen SARS-CoV-2. Diese Untersuchung liefert Hinweise darauf, dass beide Wirkstoffe auch die Viruslast bei Patienten senken und in prospektiven klinischen Studien weiter untersucht werden könnten.1
PCLS, humane Lungenpräzisionsschnitte (precision-cut lung slices)
Zellkultur-Ergebnisse in patientennahem Replikationssystem bestätigt1
Aktuelle Forschungsergebnisse an antiviralen Medikamenten gegen SARS-CoV-2 haben gezeigt, dass die Übertragung aus einem zellkulturbasierten System wie VeroE6-Zellen nicht immer zu aktiven Therapien für Patienten führt. Chloroquin beispielsweise zeigt in diesen Zellen antivirale Aktivität, nicht aber in Calu3-Zellen, menschlichen Epithelgewebemodellen, Makaken oder bei Patienten.13,14 Daher wurden die Auswirkungen von ASS und SS in der vorgestellten Studie auch in einem patientennahen Replikationssystem von humanen Lungenpräzisionsschnitten (PCLS) untersucht, da so zuvor bereits erfolgreich die Wirkung von Fluoxetin auf SARS-CoV-2 untersucht wurde15. ASS hemmte in PCLS die virale Replikation um etwa eine Größenordnung, während die Behandlung mit SS die Viruslast um mehr als zwei Größenordnungen reduzieren konnte.1
Zusatzbenefit des Erkältungs-Multitalents Aspirin® für Ihre Patient:innen?
Auch in dieser Saison können Erkältungsbeschwerden durch verschiedene Viren ausgelöst werden, unter anderem SARS-CoV-2. Die Erkenntnisse über antivirale Eigenschaften von ASS aus der aktuellen Forschung können daher für Ihre Patient:innen mit Erkältungssymptomen jeglicher Ursache relevant sein.
- Bei Erkältungskrankheiten ist Aspirin® bewährt und lindert die Symptome.2,3
- Aktuelle in vitro Untersuchungen zu SARS-CoV-2 stützen die breite antivirale Dimension von ASS in Aspirin®: Es unterdrückt in vitro nicht nur signifikant die Virusreplikation von bekannten Erkältungsviren wie Influenza- oder Rhinoviren4-6, sondern auch von SARS-CoV-2*1
- Dabei profitieren die Patient:innen von 125 Jahren Erfahrung in der Anwendung von Aspirin® bei (erkältungsbedingten) Schmerzen und Fieber.
Mit Ihrer Empfehlung von Aspirin® auf dem Grünen Rezept können Sie Ihren Patient:innen mit Erkältungssymptomen die Erkenntnisse aus der aktuellen Forschung mitgeben.
* ASS und Salicylsäure zeigten antivirale Eigenschaften gegen SARS-CoV-2 in zellbiologischen Untersuchungen und humanen Lungenschnitten1 Bei den antiviralen Effekten handelt es sich um Hinweise aus in vitro und ex vivo Untersuchungen, die in klinischen Studien verifiziert werden müssen.

Quellen:
- Geiger, N et al. Vaccines 2022;10(10):1619.
- Fachinformation Aspirin® Plus C, aktueller Stand.
- Fachinformation Aspirin® Complex, aktueller Stand.
- Glatthaar-Saalmüller, B et al. Influenza Respir. Viruses 2017;11(1):85-92.
- Mazur, I et al. Cell. Microbiol. 2007;9(7):1683–1694.
- Droebner, K et al. Front. Microbiol. 2017;8:2130. doi: 10.3389/fmicb.2017.02130.
- Liu, F et al. Front. Cell. Infect. Microbiol. 2021;11:701278.
- Avota, E et al. Front. Physiol. 2021;12:715527.
- Perlman, S et al. Fields Virology 2021;1:410–48.
- Kumar, N et al. J. Virol. 2008;82:9880–89.
- Jancso, G et al. J. Cardiovasc. Pharm. 2005;46:295–301.
- Nilsson-Payant, Beet al. J. Virol. 2021;95:e0125721.
- Hoffmann, M, et al. Nature 2020;585:588–590.
- Maisonnasse, P, et al. 2020;585:584–587.
- Zimniak, M et al. Sci. Rep. 2021;11:5890.
- Tantry, U, Schroer K, et al. J Exp Pharmacol 2021:13 957–970.
- Chen W. et al, Comput Math Methods Med 2021:9926249.
- Soria ME. et al, Access Microbiol 2021;3(9):000259.


